1.ऐसी धातु का उदाहरण दीजिए जो
(a) कमरे के ताप पर द्रव होती है
(b) चाकू से आसानी से काटा जा सकता है |
(c) ऊष्मा की सबसे अच्छी चालक होती है।
(d) ऊष्मा की कुचालक होती है।
(a) मर्करी |
(b) सोडियम , लिथियम और पौटैशियम |
(c) सिल्वर तथा कॉपर |
(d) लेड और मर्करी |
2.आघातवर्ध्य तथा तन्य का अर्थ बताइए।
3.सोडियम को केरोसिन में डुबोकर क्यों रखा जाता हैं ?
4.इन अभिक्रियाओं के लिए समीकरण लिखिएः
(a) भाप के साथ आयरन।
(b) जल साथ कैल्सियम तथा पोटैशियम।
(b) जल साथ कैल्सियम तथा पोटैशियम।
(a). 3Fe(s)+ 4H2O(g)→ Fe3O4+4H2(g)
(b). Ca(s)+2H2O(I)→ Ca(OH)2 (aq)+H2(g)
5.A,B,C एवं D चार धातुओं के नमूनों को लेकर एक-एक करके निम्न विलयन में डाला गया। इससे प्राप्त परिणाम को निम्न प्रकार से सारणीबदध किया गया है ? इस सारणी का उपयोग कर धातुA ,B, C एवं D के संबंध में निम्न प्रश्नों के उत्तर दीजिएः
(a) सबसे अधिक अभिक्रियाशील धातु कौन सी है?
(b) धातु B को कॉपर (ii) सल्फेट के विलयन में डाला जाए तो क्या होगा?
(c) धातु A, B, C एवं D को अभिक्रियाशीलता के घटते हुए क्रम में व्यवस्थित कीजिए।
6.अभिक्रियाशील धातु को तनु हाइड्रोक्लोरिक अम्ल में डाला जाता है तो कौन सी गैस निकलतीहै? आयरन के साथ तनु H2SO4 की रासायनिक अभिक्रिया लिखिए। है? हाइड्रोजन गैस विसर्जित होती है | Fe (s) + H2SO4 → FeSO4 (aq) + H2 (g)
हाइड्रोजन गैस विसर्जित होती है |
Fe (s) + H2SO4 → FeSO4 (aq) + H2 (g)
7.जिंक को आयरन (ii) सल्फेट के विलयन में डालने से क्या होता है? इसकी रासायनिक अभिक्रिया लिखिए।
जिंक को आयरन सल्फेट के विलयन से आयरन को विस्थापित कर देते है |
Zn + FeSO4 → ZnSO4 + Fe
8.आयनिक यौगिकों का गलनांक उच्च क्यों होता है ?
9. निम्न पदों की परिभाषा दीजिएः
(i) खनिज
(ii) अयस्क
(iii) गैंग
(ii) अयस्क
(iii) गैंग
(i) खनिज वे पदार्थ होते है जिनमे धातुएँ अपने यौगिक के रूप में पाई जाती है |
(ii) ऐसे खनिज जिनमे धातुओ का निष्कर्षण अत्याधिक सरल व उपयुक्त होता है , अयस्क कहलाते है |
(iii) खनिज प्रकृति में शुद्ध रूप से प्राप्त नहीं होते है उनमे उपस्थित अशुद्धियो को गैंग कहते है |
10. दो धातुओं के नाम बताइए जो प्रकृति में मुक्त अवस्था में पाई जाती हैं।
11. जिंक , मैग्नीशियम एवं कॉपर के धात्विक ऑक्साइडों को निम्न धातुओं के साथ गर्म किया गयाः किस स्थिति में विस्थापन अभिक्रिया घटित होगी?
(i) जिंक ऑक्साइड तथा मेग्नेशियम में विस्थापन अभिक्रिया होगी ।
ZnO++Mg→MgO+Zn
(ii) मेग्नेशियम ऑक्साइड विस्थापन अभिक्रिया नहीं कर सकता ।
(iii)कॉपर, ऑक्साइड जिंक और मेग्नेशियम के साथ गर्म करने पर विस्थापन अभिक्रिया देगा ।
CuO+Zn→ZnO+Cu
CuO+Mg→MgO+Cu
12.कौन सी धातु आसानी से संक्षारित नहीं होती है?
13.मिश्रातु क्या होते हैं?
14. आपको एक हथौड़ा, बैटरी, बल्ब, तार एवं स्विच दिया गया हैः
(a) इनका उपयोग कर धातुओं एवं अधातुओं के नमूनों के बीच आप विभेद कैसे कर सकते हैं?
(b) धातुओं एवं अधातुओं में विभेदन के लिए इन परीक्षणों की उपयोगिताओं का आकलन कीजिए।
- हथौड़े से पीटकर – धातु की पतली चादर प्राप्त होती है | जबकि आधातु भंगुर होती है अतः छोटे – छोटे टुकड़ो में बिखर जाएगी |
- विद्युत् परिपथ द्वारा – सर्वप्रथम बल्ब, बैटरी, तार तथा स्विच का उपयोग कर निम्न परिपथ बनाईए | इसके बाद बारी – बारी से धातुए और आधातुए के दिए गए नमूने को विद्युत् परिपथ के क्लिप में लगाकर स्विच को ऑन करते है| तो हम देखेंगे की धातुओ की स्थिति में वलब जलने लगता है जबकि आधतुओ के साथ बल्ब नहीं जलता है |
(b) परिक्षण (a)
(ii) ज्यादा उपयुक्त तरीका है क्योंकि ग्रेफाइट एक धातु है , परन्तु विद्युत् का सुचालक है इसलिए इसके साथ भी बल्ब जलने लगेगा |
15. उभयधर्मी ऑक्साइड क्या होते हैं? दो उभयधर्मी ऑक्साइडों का उदाहरण दीजिए।
ऐसे धातु ऑक्साइड जो अम्ल तथा क्षारक दोनों से आभिक्रिया करके लवण तथा जल प्रदान करते है , उभयधर्मी ऑक्साइड कहलाते है|
उदाहरण : ऐलुमिनियम ओक्साइड (Al2O3) और जिंक ऑक्साइड (ZnO)
16.दो धातुओं के नाम बताइए जो तनु अम्ल से हाइड्रोजन को विस्थापित कर देंगे, तथा दो धातुएँ जो ऐसा नहीं कर सकती हैं।
17.किसी धातु M के विद्युत अपघटनी परिष्करण में आप ऐनोड, कैथोड एवं विद्युत अपघट्य किसे बनाएँगे?
धातु M के विद्युत अपघटनी परिष्करण मे के लिए –
अशुद्ध धातु M का → ऐनोड
शुद्ध धातु M कि पतली पट्टी → कैथोड
विद्युत अपघट्य → M धातु का अम्लीक्रित लवण का विलयन
18.प्रत्यूष ने सल्फर चूर्ण को स्पैचुला में लेकर उसे गर्म किया। चित्रा के अनुसार एक परखनली को उलटा कर के उसने उत्सर्जित गैस को एकत्रा किया
(a) गैस की क्रिया क्या होगी? (i) सूखे लिटमस पत्र पर (ii) आर्द्र लिटमस पत्र पर।
(b) ऊपर की अभिक्रियाओं के लिए संतुलित रासायनिक अभिक्रिया लिखिए।

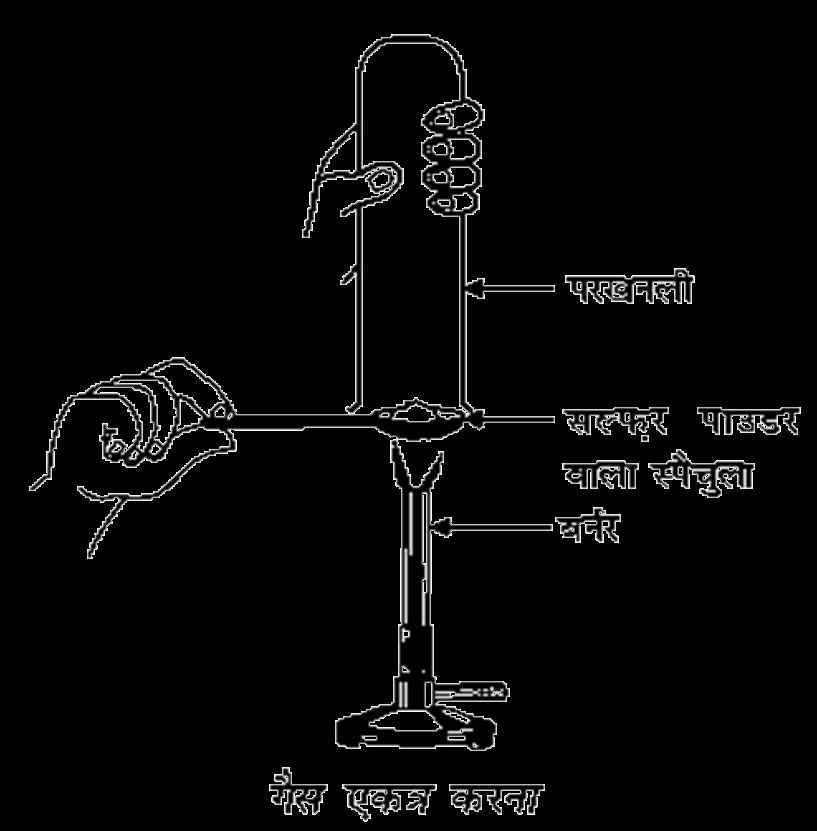
a) सल्फर जलने पर सल्फर डाइऑक्साइड उत्पन्न करता है।
S(s) + O2 I SO2 (q)
सल्फर डाइऑक्साइड
(i) सूखे लिटमस पत्र पर गैस की कोई भी क्रिया नहीं होगी।
(ii) गैस आर्द्र लिटमस पत्र में मौजूद जल के साथ अभिक्रिया कर सल्फ्यूरिक अम्ल उत्पन्न करेगी जो नीले लिटमस पत्र को लाल कर देगा।
(b) SO2 (g) + H2O I H2 SO3 (aq)
(सल्फ्यूरस)
19.लोहे को जंग से बचाने के लिए दो तरीके बताइए।
लोहे को जंग से बचाने के लिए दो तरीके निम्न है:
(i) यशदलेपन द्वारा – इस विधि में लौहे एवं इस्पात पर जिंक की पतली परत चढ़ाई जाती है |
(ii) पेंटिंग द्वारा – इस विधि में लौहे की वस्तु पर पेंट कर देते है, ताकि इसकी सतह वायु और आर्द्रता के सीधे सम्पर्क में ना रहे |
20.ऑक्सीजन के साथ संयुक्त होकर अधातुएँ कैसे ऑक्साइड बनाती हैं?
21.कारण बताइएः
(a) प्लैटिनम, सोना एवं चांँदी का उपयोग आभूषण बनाने के लिए किया जाता है।
(b) सोडियम, पोटैशियम एवं लीथियम को तेल के अंदर संग्रहीत किया जाता है।
(c) ऐलुमिनियम अत्यंत अभिक्रियाशील धातु है,फिर भी इसका उपयोग खाना बनाने वाले बर्तन बनाने के लिए किया जाता है।
(d) निष्कर्षण प्रक्रम में कार्बोनेट एवं सल्फाइड अयस्क को ऑक्साइड में परिवर्तित किया जाता है।
(a) प्लैटिनम, सोना एवं चांँदी चमकदार धातुए है एवं संक्षारित भी नहीं होती है अतः इनका उपयोग आभूषण बनाने के लिए किया जाता है।
(b) सोडियम, पोटैशियम एवं लीथियम वायु में खुला छोड़ने पर अपनी अत्याधिक क्रियाशीलता के कारण आसानी से आग पकड़ लेती है | अतः इसको तेल के अंदर संग्रहीत किया जाता है।
(c) ऐलुमिनियम के बर्तन आसानी से संक्षारित नहीं होते अतः यह ऊष्मा के सुचालक है |
(d) धातुओ को उनके ऑक्साइड से पृथक करना ज्यादा आसान प्रक्रिया है अतः निष्कर्षण प्रक्रम में कार्बोनेट एवं सल्फाइड अयस्क को ऑक्साइड में परिवर्तित किया जाता है।
22. आपने ताँबे के मलीन बर्तन को नींबू या इमली के रस से साफ करते अवश्य देखा होगा। यह खट्टे पदार्थ बर्तन को साफ करने में क्यों प्रभावी हैं?
23.रासायनिक गुणधर्मों के आधार पर धातुओं एवं अधातुओं में विभेद कीजिए।
धातु के रासायनिक गुणधर्म :
(i) धातुए क्षारकीय ऑक्साइड बनाती है |
(ii) धातु अपचायक होती है |
(iii) धातुए जल से हाइड्रोजन को विस्थापित कर देती है |
